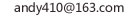c为N
a为H
⑷在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)2CA3(g)
ΔH=-92.4 kJ·mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,总容积为1.0 L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol,A2 0.5mol,CA3 0mol
B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L,CA3 0.2mol/L
选BC求解析过程
A.C2 0.6mol,A2 0.5mol,CA3 0mol N2 + 3H2 === 2NH3
0.6 0.5 0
变化量 0.1 0.3 0.2
平衡时 0.6-0.1 0.5-0.3 0.2
(0.5) (0.2) (0.2)和原平衡一样
B.C2 0mol,A2 0mol,CA3 1.2mol N2 + 3H2 === 2NH3
0 0 1.2
变化量 0.5 1.5 1.2-0.2
平衡时 0.5 1.5 0.2 和原平衡不一样
注:这个平衡是从逆反应开始的,要想和原平衡一样,则平衡时NH3 应为0.2mol,所以,NH3的变化量为1.2-0.2=1.0mol
C.C2 0.6mol/L,A2 0.5mol/L,CA3 0.2mol/L N2 + 3H2 === 2NH3
0.6 0.5 0.2
变化量 0 0 0
平衡时 0.6 0.5 0.2 和原平衡不一样
注:要想和原平衡一样,则平衡时NH3 应为0.2mol,所以,NH3的变化量为0.2-0.2=0mol
所以,答案:B ,C
化学平衡方程式:N2 + 3H2 == 2NH3,然后分析选项。
A、 N2 + 3H2 == 2NH3
初始: 0.6 0.5 0
平衡时: 0.5 0.2 0.2
参加反应:0.6-0.5=0.1 0.5-0.2=0.3 0.2 符合反应物质的量变化,可能。
B、
初始: 0 0 1.2
平衡时: 0.5V 0.2V 0.2V
参加反应:0.5V 0.2V 1.2-0.2V
据化学反应性质:0.5V/1=0.2V/3=1.2-0.2V,解方程组,可得5=2/3,所以不可能。
C、
初始: 0.6mol/LxV1 0.5mol/LxV1 0.2mol/LxV1
平衡时: 0.5mol/LxV2 0.2mol/LxV2 0.2mol/LxV2
参加反应:0.6V1—0.5V2 0.5V1—0.2V2 0.2V1—0.2V2
据化学反应性质:(0.6V1—0.5V2)/1=(0.2V2—0.2V1)/2且(0.5V1—0.2V2 )/3=(0.2V2—0.2V1)/2解方程组得:V1=-3V2,体积不可能是负数,和实际情况不符,不可能。
容器中氮原子为1.2mol氢原子为0.7mol平衡后不会变
B中显然氢原子不对
C中都不对
高三化学平衡方面的两个简单问题
(a>b)的盒子,两个摞在一起,因为是体积不变,如果两个摞在一起是2倍体积,而平衡不动,若保持体积不变,则需把二倍体积压成原体积,故相当于加压,平衡向气体分子数减少的正向移动;若是压强不变,也就是摞在一起不再有任何的措施,所以平衡是不动的。2、不是的。因为反应达到平衡时是在该...
高三化学,请教高手 化学平衡状态的标志,混合气体的平均相对分子质量和...
记住一句话,反应前后会发生改变的量才能作为判断化学平衡的标志。所以,当化学方程式两边的物质(一般只气体)的分子量之和有变化时,混合气体的平均相对分子质量才能作为判断的依据;同样,当方程式两边分子系数之和不相等时,便可以作为判断平衡的标志
高中化学平衡的知识点
(1)温度:在其他条件不变的情况下,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。(2)浓度:在其他条件不变的情况下,增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动。(3)压强:对于反应前后总体积...
高三化学平衡题
N2+3H2=NH3 (我打不出化学式)1:2.8时属于氢气多,这时按照氮气来看1:3时,和化学式中的比一样,所以小于15%因为同温同压,上面一种情况会右移,所以1:3时,小于。氨气的氮氢元素比为1:3,若初始物质量比为1:3的就是平衡时转化率最高的比例,所以氨气的体积分数应该是大于原来的。...
高三化学平衡
C、初始: 0.6mol\/LxV1 0.5mol\/LxV1 0.2mol\/LxV1平衡时: 0.5mol\/LxV2 0.2mol\/LxV2 0.2mol\/LxV2参加反应:0.6V1—0.5V2 0.5V1—0.2V2 0.2V1—0.2V2据化学反应性质:(0.6V1—0.5V2)\/1=(0.2V2—0.2V1)\/2且(0.5V1—0.2V2 )\/3=...
高三化学平衡问题,向一体积不变的密闭容器中加人2mol X、0. 6mol Z...
由图可知,2X + Y === 3Z 初始时 2mol 1mol 0.6mol 由于反应前后气体体积不变,是等效平衡,可以把上式换算成按反应物投料 2X + Y === 3Z 初始时 2.4mol 1.2mol 0 若初始加入amolX 、bmolY 、cmolZ 2X + Y === 3Z 初...
高三化学,在线等,化学平衡计算方面
N2+3H2==2NH3 都可逆 隔板处于中间,说明两侧压强相同,即气体物质的量相同,注意用极限法。二氧化硫的转化率与氮气的转换率之比为5比1,不放就设SO2为100%,N2转化率为20%(说明 :严格来说可逆反应100%是不可能的,但由于是比值,这样设可以简化计算,不会影响结果 的)那么,左边只有2molSO...
高中化学平衡铵根~~急急急高三那、、、谢了!
pH值小于7的时候,说明溶液中是氨水和氯化铵的混合物,且一水合氨的浓度比第一个小 所以,当pH等于7的时候,溶液中铵根的浓度就等于氯离子的浓度,也就是0.1mol\/L pH大于7的时候,氢氧根增加,所以铵根离子也增加 小于7的时候,铵根离子减小 一切都源于电荷守恒。平衡不太好解决问题 用...
一个高三化学问题(平衡问题)
这样可以提高你做题的信心以及"化学素养"(有点装)。下面是从平衡移动的角度“感性”解题,首先我假设你这是个等压体系吧,前提是B相对于A的量越多,A的转化率越大,不知道这个前提你是否能够接受。让反应逆向进行完全,此时AB有一定比例,加入A的同时加入与上述比例相同的B,A的转化率是不变的,只...
2009山东省烟台市高三模块考试一个化学平衡问题
已知“反应速率与反应物浓的关系为v=kc(NO2)”即总反应速率随着NO2的加入而增加,同时因为增加的是反应物浓度,故正反应速率增加,故A选项前半部分正确。至于平衡的移动,也是由于浓度的改变引起的,与速率的改变不是因果关系。平衡的结果是体系达到最终稳定的状态,此题反应物浓度增加,为了使体系稳定...